Liczba Protonów I Elektronów Magnezu

Zrozumienie budowy atomu to klucz do poznania właściwości materii. Jednym z najważniejszych aspektów tej budowy jest liczba protonów i elektronów, a szczególnie interesujące jest to w przypadku pierwiastków takich jak magnez (Mg). Przyjrzyjmy się zatem szczegółowo liczbie protonów i elektronów magnezu, co pozwoli nam lepiej zrozumieć jego pozycję w układzie okresowym i jego zachowanie chemiczne.
Podstawy Budowy Atomu
Zanim przejdziemy do magnezu, warto przypomnieć sobie podstawowe elementy budowy atomu:
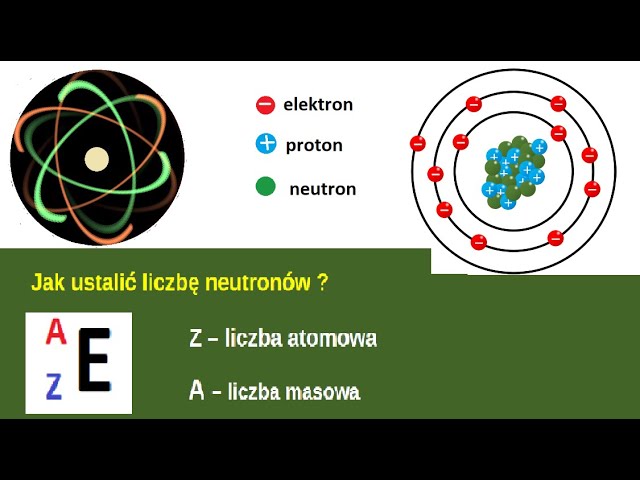
- Protony: Cząstki o ładunku dodatnim, znajdujące się w jądrze atomowym. Liczba protonów w jądrze atomowym definiuje liczbę atomową (Z) pierwiastka i determinuje, jakim pierwiastkiem jest dany atom.
- Neutrony: Cząstki obojętne elektrycznie, również znajdujące się w jądrze atomowym. Liczba neutronów może się różnić w atomach tego samego pierwiastka, tworząc izotopy.
- Elektrony: Cząstki o ładunku ujemnym, krążące wokół jądra atomowego w tzw. powłokach elektronowych.
Atom w stanie obojętnym elektrycznie ma tyle samo protonów co elektronów. To równoważy ładunki dodatnie i ujemne, czyniąc atom neutralnym.
Magnez (Mg): Liczba Atomowa i Protony
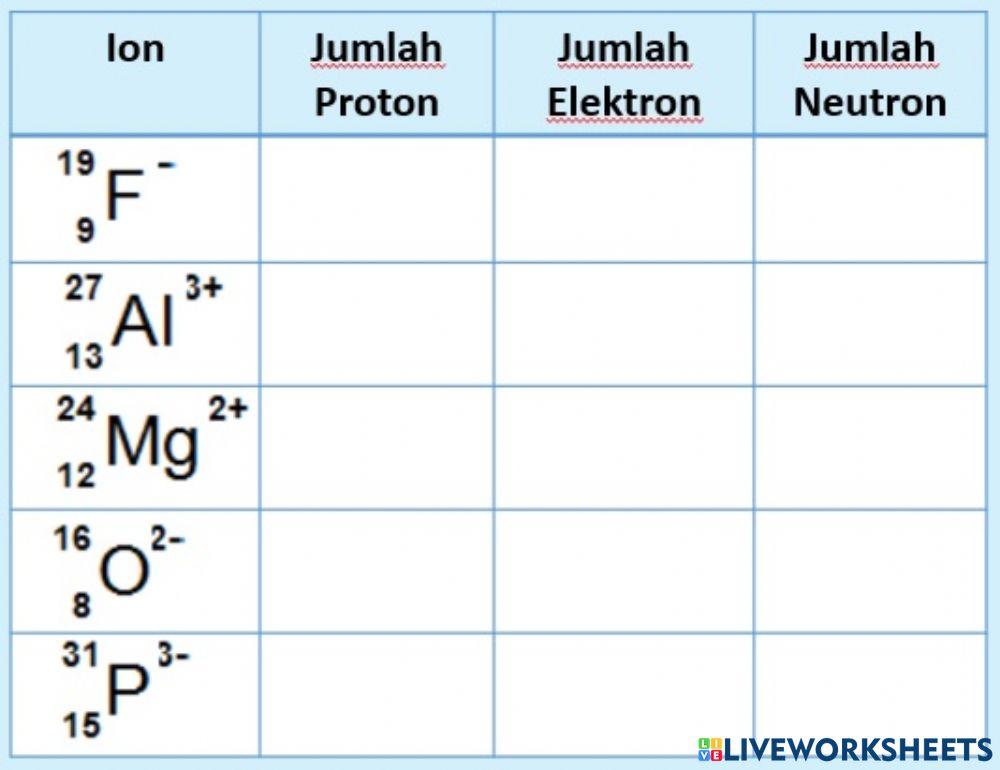
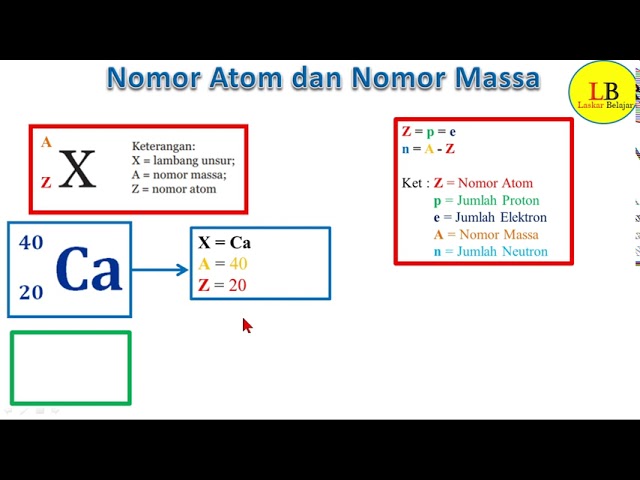
Magnez (Mg) w układzie okresowym znajduje się w grupie 2 (zwanej też grupą berylowców) i ma liczbę atomową (Z) równą 12. Co to oznacza? Oznacza to, że każdy atom magnezu posiada w swoim jądrze dokładnie 12 protonów. To właśnie ta liczba protonów definuje magnez jako magnez – żaden inny pierwiastek nie ma 12 protonów w swoim jądrze.
Pamiętaj: Liczba atomowa (Z) = liczba protonów.
Zmiana liczby protonów w jądrze atomowym prowadzi do powstania zupełnie innego pierwiastka. Na przykład, gdyby atom magnezu nagle miał 11 protonów, stałby się atomem sodu (Na).
Liczba Elektronów w Atomie Magnezu
Jak wspomnieliśmy wcześniej, w atomie obojętnym elektrycznie, liczba protonów jest równa liczbie elektronów. Zatem, atom magnezu (Mg) w stanie obojętnym ma 12 elektronów. Te elektrony nie krążą chaotycznie wokół jądra, lecz są rozmieszczone na określonych powłokach elektronowych.
Konfiguracja Elektronowa Magnezu
Elektrony rozmieszczają się na powłokach elektronowych zgodnie z określonymi zasadami. Powłoki te są numerowane: K (n=1), L (n=2), M (n=3) itd. Każda powłoka może pomieścić maksymalną liczbę elektronów, obliczaną ze wzoru 2n2.
Konfiguracja elektronowa magnezu wygląda następująco:
- Powłoka K (n=1): 2 elektrony
- Powłoka L (n=2): 8 elektronów
- Powłoka M (n=3): 2 elektrony
Zapis konfiguracji elektronowej magnezu to: 1s2 2s2 2p6 3s2 lub skrótowo [Ne] 3s2, gdzie [Ne] oznacza konfigurację elektronową neonu (1s2 2s2 2p6), który poprzedza magnez w układzie okresowym.
Jony Magnezu (Mg2+)
Atomy magnezu dążą do uzyskania stabilnej konfiguracji elektronowej, czyli takiej, jaką mają gazy szlachetne (8 elektronów na ostatniej powłoce – oktet elektronowy). Aby to osiągnąć, magnez oddaje 2 elektrony z ostatniej powłoki (3s2). Kiedy atom magnezu traci 2 elektrony, staje się jonem magnezu (Mg2+).
Jon Mg2+ ma:
- 12 protonów (liczba protonów się nie zmienia)
- 10 elektronów (12 - 2 = 10)
Ponieważ jon Mg2+ ma więcej protonów (12) niż elektronów (10), posiada ładunek dodatni (+2). Jon magnezu ma konfigurację elektronową neonu (Ne), co czyni go stabilnym.
Znaczenie Liczby Protonów i Elektronów Magnezu
Znajomość liczby protonów i elektronów w atomie magnezu (i w ogóle w każdym atomie) jest kluczowa do zrozumienia jego właściwości chemicznych i fizycznych. Oto kilka przykładów:
- Reaktywność: Magnez łatwo oddaje 2 elektrony, tworząc jon Mg2+, co czyni go reaktywnym metalem. Bierze udział w wielu reakcjach chemicznych, np. reaguje z tlenem, tworząc tlenek magnezu (MgO).
- Tworzenie związków: Jony Mg2+ występują w wielu ważnych związkach chemicznych, takich jak chlorek magnezu (MgCl2) i węglan magnezu (MgCO3).
- Właściwości fizyczne: Konfiguracja elektronowa wpływa na właściwości fizyczne magnezu, takie jak przewodnictwo elektryczne i cieplne.
- Biologia: Jony Mg2+ odgrywają kluczową rolę w biologii, m.in. w funkcjonowaniu enzymów, przewodnictwie nerwowym i budowie kości. Chlorofil, niezbędny do fotosyntezy u roślin, zawiera atom magnezu.
Podsumowując, magnez (Mg) ma 12 protonów i 12 elektronów (w stanie obojętnym). Zrozumienie tej prostej zasady otwiera drzwi do zrozumienia bardziej złożonych zagadnień chemicznych i biologicznych.